
编者按
今年国际糖尿病领域极具影响力的国际会议——第84届美国糖尿病协会科学年会(ADA2024)于6月21~24日在美国奥兰多举行。本届ADA年会上,首都医科大学附属北京同仁医院、北京市糖尿病研究所杨金奎教授团队共有4项研究成果展示,分别是关于hERG钾离子通道与肠促胰素分泌的调控作用及机制研究、新型Cathepsin L抑制剂治疗糖尿病肾病(DKD)的效果、糖尿病性黄斑水肿(DME)的血浆代谢组学分析、2型糖尿病(T2DM)患者DKD模型的机器学习算法开发与内部验证。本刊特邀杨教授团队对这些研究结果进行报道。4项研究的第一作者分别是博士研究生袁颖超、赵苗妙博士、朱晓蓉副主任医师、张琳副主任医师。
hERG钾离子通道作为GLP-1和GIP促分泌剂治疗糖尿病和肥胖的新靶点
2043-LB
袁颖超,王昊,杨金奎
胰高糖素样肽-1(GLP-1)和葡萄糖依赖性胰岛素肽(GIP)来源于肠内分泌细胞(EECs),作为肠促胰素激素在血糖调节中发挥重要作用。虽然针对GLP-1类似物和GLP-1受体激动剂的药物被广泛用于治疗T2DM和肥胖,但仍需要刺激内源性肠促胰素分泌的药物。
在这项研究中,我们揭示了hERG钾离子通道在调节肠促胰素分泌中的关键作用。hERG通道与EECs在小鼠肠上皮中的共定位强调了它们的重要性。小鼠肠道特异性敲除hERG可增强葡萄糖耐量,增加口服葡萄糖摄入后GLP-1和GIP分泌。此外,缺乏hERG的原代肠上皮细胞在葡萄糖刺激下表现出更高的肠促胰素分泌。在机制上,hERG缺乏导致电压门控钾通道(Kv)电流降低,EECs的动作电位复极化时间延长,导致Ca2+内流和细胞内Ca2+积累增加,最终导致肠促胰素分泌增加。
考虑到与GLP-1和GIP相关的治疗益处,这些发现强调了hERG作为治疗肥胖和糖尿病的新靶点的潜力。

新型Cathepsin L抑制剂治疗糖尿病肾病的效果
1782-LB
赵苗妙,李小亚,李明嘉,杨金奎
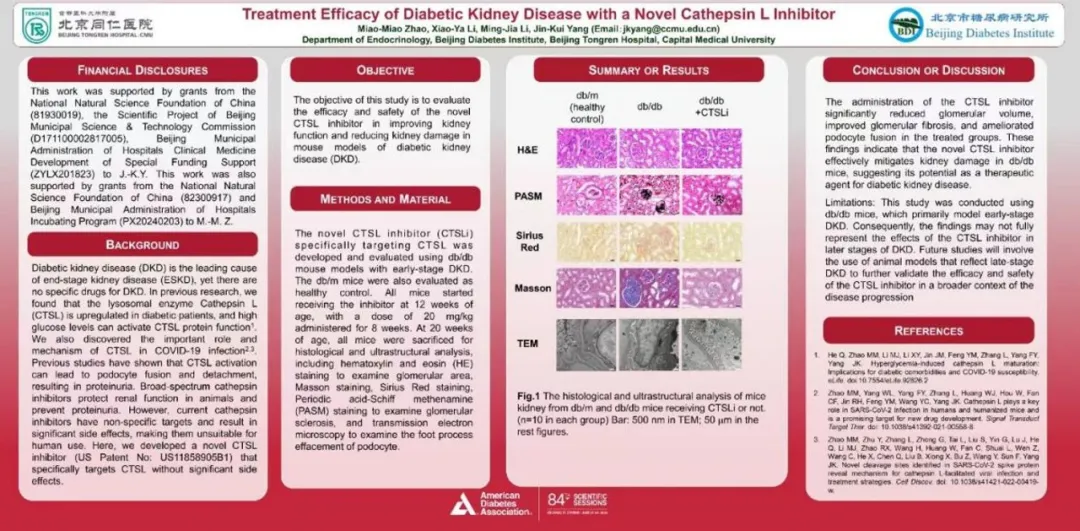
糖尿病肾病(DKD)是终末期肾病(ESRD)的主要病因,但目前尚无治疗DKD的特效药物。在前期研究中,我们发现糖尿病患者体内Cathepsin L(CTSL)表达上调,高血糖水平可以激活CTSL蛋白功能。此前的研究表明,CTSL激活可导致足细胞融合和脱离,从而导致蛋白尿。广谱Cathepsin抑制剂可保护动物的肾功能并预防蛋白尿。然而,目前的Cathepsin抑制剂靶点不单一,不能应用于人体。
在本项研究中,我们研发了一种新型的CTSL抑制剂(已获批美国专利保护),并在db/db糖尿病小鼠中验证了其对DKD的治疗效果。结果表明,这种新型CTSL抑制剂可改善小鼠肾小球肿胀,减轻肾小球硬化与肾间质纤维化,并可缓解足细胞足突融合。以上研究结果表明,这种新型CTSL抑制剂有效减轻db/db小鼠的肾损伤表型,有潜力成为新型DKD的治疗药物。
糖尿病性黄斑水肿的血浆代谢组学分析
494-P
朱晓蓉,卢晶,张琳,田玮,杨金奎
糖尿病性黄斑水肿(DME)是一种危及视力的视网膜病变,是糖尿病患者视力丧失的主要原因。尽管严格控制了全身性危险因素,但仍有一部分糖尿病患者出现了DME,表明DME潜在的致病因素还存在。这项研究旨在调查DME患者的血浆代谢型,并确定DME的新型代谢标志物。这项研究发现的生物标志物将为早期诊断和干预DME提供科学依据和新策略。
为了匹配病例和对照组受试者的临床参数,本病例对照研究将DME患者(DME,n=30)和未患DME的糖尿病患者(对照组,n=30)纳入其中。使用液相色谱-质谱法对血清中的不同代谢物进行了检测。
在DME组和对照组之间共发现了190种不同的代谢物(VIP>1,Fold Change >1.5或<0.667,且P<0.05)。DME组和对照组之间的不同代谢物富集于4条KEGG通路,即谷氨酸代谢、肉碱合成、支链脂肪酸氧化和植物酸过氧物酶体氧化。最后,4种代谢物被选为DME的候选生物标志物,即5-磷-β-D-核糖基胺、琥珀酸、抗坏血酸葡萄糖苷和谷胱甘肽二硫化物。
这项研究表明,新陈代谢障碍和4种潜在代谢物被确定为与DME相关的代谢失调,这可能为DME潜在的新致病途径提供新的见解。

T2DM患者糖尿病肾病模型的机器学习算法开发与内部验证
430-P
张琳,万晓华,张志成,宋彪,杨金奎
DKD是糖尿病患者的重要并发症之一,也是导致ESRD的主要原因。因此,DKD的早期筛查、诊断和治疗对于延缓疾病进展、提高患者生活质量具有重要意义。近年来,随着人工智能(AI)和机器学习技术的发展,利用这些先进技术对DKD进行早期筛查和风险预测已成为研究热点。
本研究旨在根据T2DM患者的临床特点和生物学指标,通过不同的机器学习算法建立DKD早期筛查模型,并比较其对DKD的预测价值。
我们选取2013~2022年在北京同仁医院住院的74 982例T2DM患者。收集的资料包括共同的临床特征和生物学指标。共有625例DKD患者和1336例非DKD患者纳入研究。通过深度神经网络(DNN)、RF、SVM、XGBoost、GMB、DRF、Naive Bayes等7种机器学习算法建立DKD早期筛选模型。
不同特征维数建立DNN:D0:血常规,AUC=0.6911;D1:血常规、舒张压、收缩压、腰臀比(WHR),AUC=0.7919;D2:D1数据集,生化指标,AUC=0.8517。评价模型的精度,DNN的AUC为0.902,而其他算法的AUC在0.81~0.88。我们研究发现,D2数据集预测效果最好,与生化指标结合预测DKD效果最好。单血常规指标对预测DKD的发展也有重要价值。与其他机器学习算法相比,DNN是最好的模型。

专家简介

杨金奎 教授
首都医科大学附属北京同仁医院、北京市糖尿病研究所
一级主任医师,博士研究生导师。享受国务院特殊津贴专家,北京市战略科学家,2019年入选“北京学者”。
首都医科大学附属北京同仁医院、北京市糖尿病研究所首任所长。糖尿病防治研究北京市重点实验室主任。北京市糖尿病防治办公室主任。首都医科大学内分泌与代谢病学系主任。
重点开展新药靶点发现与新药研发,疾病诊断与预测分子标志物研究,糖尿病微血管病变临床研究和胰岛功能基础研究。
作为首席科学家承担国家重点研发项目1项,主持国家自然科学基金重点项目、国际合作专项项目及面上项目8项。获国家新药证书3项,省级科技成果奖6项。在Diabetes Care(6篇)、Cell Discovery、Cell Reports、STTT、Nature Commmunications、eLife等发表SCI论文115篇;他引超过10 000次。
2006年发现冠状病毒ACE2受体对糖代谢的作用;2017年发现尿微量触珠蛋白预测糖尿病肾病新方法;2018年提出胰岛素分泌“双开关”控制理论;2021年发现黄连素降糖作用分子靶点;2021年发现CTSL为新冠肺炎治疗新靶点。
声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。

我要留言